Микроклоны растений бореца северного как возможный альтернативный источник сырья для получения антиаритмического препарата аллапинин
И.И. Круглова, Н.И. Федоров, Институт биологии Уфимского НЦ РАН.
E-mail: Kruglova@anrb.ru, Fedorov@anrb.ru
Борец северный (синоним: аконит высокий) - многолетнее травянистое растение из семейства лютиковых.
В корневищах и, в меньшей степени, надземной части этого ценного лекарственного растения содержится целый ряд фармакологически активных алкалоидов, таких как анторин, псевдоан-торин, аконитовый, бензилаконитовый, лаппаконитин. Особый интерес представляет лаппаконитин, на основе которого производится высокоэффективный- антиаритмический препарат алла-пинин, успешно применяемый в медицинской практике и вошедший в «Перечень жизненно необходимых и важнейших лекарственных средств», утвержденный Министерством здравоохранения Российской Федерации 03.01.1992 г.
Борец северный широко распространен на территории Республики Башкортостан. Однако в корневищах растений боре-ца северного, произрастающих на большей части территории республики, отмечается низкое содержание лаппаконитина, что делает нерентабельной их заготовку как сырья для производства препарата аллапинин. В то же время места сбора высокорентабельного сырья этого вида труднодоступны, так как приурочены к малонаселенным горным или таежным районам и при их заготовке может наноситься существенный урон всему растительному покрову.
В качестве альтернативы нами на основе ранее проведенных исследований разработана имеющая инновационный характер технология стабильного получения растений-микроклонов бореца северного из корневищных почек как способ расширения доступной сырьевой базы для производства препарата аллапинин.
Метод клонального микроразмножения in vitro (или микрокло-нального размножения in vitro) основан как на способности растений формировать клоны (новые особи, генетически идентичные между собой и исходным растением), так и на уникальном свойстве растительной клетки - ее тотипотентности (способности длительно сохранять основные генетические характеристики и при определенных условиях дать начало новой особи). Создав в культуре in vitro условия, близкие природным, и применяя фито-гормоны в сочетании с трофическими и физическими факторами культивирования, можно регулировать процесс формирования клонов. Этот метод позволяет быстро размножить ценный генотип растения; получать в больших количествах вегетативное потомство (клоны); работать в лабораторных условиях круглый год; получать растения клоны к определенному сроку; длительно хранить «пробирочные» растения при пониженных температурах, создавая «банк» ценных форм растений.
В качестве исходного материала использовали генеративные растения бореца северного из алкалоидопродуктивных локальных популяций этого вида. Ранее было установлено, что растения этих популяций имеют содержание лаппаконитина в среднем в 3-4 раза выше, чем в ресурснодоступных популяциях и отличаются от них рядом морфологических особенностей: более рассеченными листовыми пластинками, более короткими соцветиями, меньшей высотой побегов, буроватой пигментации слабо опушенных стеблей и интенсивной, преимущественно красновато-фиолетовой, окраской цветков.
Во время экспедиционных выездов по Республике Башкортостан в алкалоидопродуктивных популяциях на основании морфологических показателей отбирали генеративные растения с высоким содержанием лаппаконитина и проводили сбор их корневищ.
Дальнейшую работу проводили в лабораторных условиях.
Среди собранных корневищ на основании данных анализа содержания лаппаконитина методом ВЭЖХ отбирали почки возобновления растений-супепродуцентов лаппаконитина. С помощью цито-гистологического контроля проводили подбор почек такого размера, чтобы они содержали достаточно развитые апексы (точки роста) побега и корня, представленные меристематической тканью. Меристематические ткани - наиболее предпочтительные объекты клонального микроразмножения, поскольку в условиях in vitro способны к образованию недостающих органов и регенерации целого растения. С другой стороны, хорошо известно, что меристематическая ткань генетически стабильна на всех этапах культивирования in vitro.
Почки нужного размера отделяли от корневищ, промывали в нескольких порциях проточной воды и стерилизовали. Далее в стерильных условиях ламинарного бокса стерильными инструментами почки инокулировали в подготовленные пробирки с питательной средой. Использовали питательную среду Мурасиге-Скуга (MS), содержащую необходимый набор макро- и микроэлементов. В состав среды вводили фитогормоны индолил-3-уксусную кислоту и кинетин в эмпирически подобранных концентрациях, адекватных для индукции побего- и корнеобразования (таблица).
Таблица
Состав питательной среды для культивирования in vitro почек возобновления бореца северного
| Компоненты среды | Концентрация, мг/л |
| Макросоли по MS | 20.2 |
| Микросоли по MS | 0.6 |
| Индолил-З-уксусная кислота | 2.0 |
| Кинетин | 2.0 |
| Сахароза | 11000 |
| Агар | 7000 |
| Аскорбиновая кислота | 0.4 |
| Вода бидистиллированная | До 1000 мл |
Через 30-35 сут культивирования in vitro почки давали начало проросткам микроклонов растений-суперпродуцентов (рис., 1), которые затем переносили в условия ex vitro в вегетационные сосуды в эмпирически подобранные условия (состав почвенной смеси, освещенность, температурный режим и влажность), оптимальные для получения растений с хорошо развитой корневой системой (рис., 2).
Через 40-45 сут растения-микроклоны переносили в условия модельных опытов на полевые участки научного стационара Института биологии Уфимского НЦ РАН. Проводили оценку содержания лаппаконитина в корневищах клонированных растений методом ВЭЖХ и отбор суперпродуцентов для дальнейшей работы.
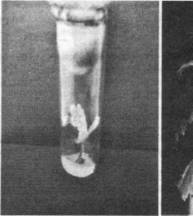
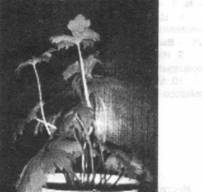
Рис. 1 - проросток микроклона растения-суперпродуцента бореца северного в пробирке, х 0.3; 2 - микроклон растения-суперпродуцента бореца северного в вегетационном сосуде, х 0.1.
Таким образом, разработана.и апробирована технология кло-нального микроразмножения in vitro бореца северного (аконита высокого). Похожий опыт введения в асептическую культуру in vitro бореца (аконита), но другого вида - аконита луковичного -был проведен в Японии, но не имел успеха.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. - M.: ФБК-ПРЕСС, 1999. - 160 с.
- Высоцкий В.А. Клональное микроразмножение растений // Культура клеток растений и биотехнология. - М.: Наука, 1986. - С. 191-202.
- Горбунова В.Ю., Круглова H.H. Микроклональное размножение аконита высокого - продуцента антиаритмического алкалоида // Вопросы биотехнологии. - Уфа: БашГУ, 1995. - С. 115-119.
- Лутова Л.А. Биотехнология высших растений. - СПб.: Изд-во Санкт-Петербургского ун-та, 2003. - 227 с.
- Федоров Н.И., Ишбирдина Л.М., Янбаев Ю.А., Исангулова А.А. Закономерности генетической и морфологической изменчивости растений борца северного (Aconitum septentrionale Koelle) вдоль высотного градиента на горном массиве Иремель // Экология. - 1999. - № 4. - С. 261-265.
- Федоров Н.И., Мартьянов H.A. Особенности распространения и динамики популяций Aconitum septentrionale Koelle в растительных сообществах Башкортостана // Растительные ресурсы. - 1993. - Т. 27. - Вып. 3. - С. 29-34.
ЛИТЕРАТУРА
- Федоров Н.И., Мартьянов Н.А., Никитина B.C., Ишбирдина Л.М. Содержание алкалоида лаппаконитина в подземной и надземной частях Aconitum septentrionale Koelle в растительных сообществах в Башкирии // Растительные ресурсы. - 1996. - № 3. - С. 96-101.
- Цицилин A.H., Шретер А.И. Прогноз природных ресурсов Aconitum septentrionale Koelle в Башкирской АССР // Растительные ресурсы. - 1990. - Т. 26. - Вып. 4. - С. 513-539.
- Hatano К. Clonal multiplication by tip tissue and alkaloid contents of clonally propagated plants // Planta medica. - 1988. - V. 1. - № 5. - P. 22-26.
- Murashige Т., Skoog F. A revised medium for rapid growth .and bioassays with tobacco cultures // Physiol. Plant. - 1962. - V. 15. - № 3. - P. 473-497.