Структурообразование в фитосистемах хитозана
В.И. Фомина, Н.А. Солонина, Б.А. Комаров, А.Б. Шиповская. Саратовский госуниверситет им. Н.Г. Чернышевского, Россия "Научно-исследовательский институт химии СГУ, г. Саратов, Институт проблем химической физики РАН, г. Черноголовка.
Известно о высокой эффективности фитохитодезтерапии [1-4]. Однако природа лечебного действия фитохитодезов, фитопрепаратов хитозана (ХТЗ), до настоящего времени изучена недостаточно.
Исследование физико-химических свойств фиторастворов ХТЗ в кислой среде представляет интерес для моделирования поведения фитохитодезов в организме на первом этапе. Ранее нами изучены вискозиметрические и оптические свойства фиторастворов ХТЗ с компонентами водных настоев сухих листьев крапивы и травы мелиссы [5, 6]. В настоящей работе методами вискозиметрии, спект-рофотометрии и спектра мутности изучали влияние настоев крапивы, полученных из разных частей лекарственного растения, на процессы структурообразования в фитосистемах ХТЗ.
Использовали образец ХТЗ (ВНИТИБП - ЗАО «Биопрогресс», ТУ 2481-001-11734126-93) с молекулярной массой Мп=640000 и степенью деацетилирования СД=0.83, настои сухих листьев и свежих корней крапивы в воде и ацетатном буфере: 0.33 М раствор уксусной кислоты и 0.2 М раствор уксуснокислого натрия (рН=4,4). Исходный водный настой сухих листьев крапивы готовили согласно [6]. Исходный водный настой корней крапивы получали, заливая 10 г корней 100 мл дистиллированной воды с Т=60° С и выдерживая систему при этой температуре 5 часов. Раствор полисахарида концентрации 0.05 г/дл и фитосистемы ХТЗ концентрации 0.44 г/дл готовили по методике [5]. Фитосистемы хранили в статических условиях при 20+2 и ~ 6° С.
Вискозиметрические измерения проводили в вискозиметре Уббе-лоде (d=0.54 мм) при 25 и 40° С. Степень деацетилирования полимера определяли методом потенциометрии.
Оптическую плотность (D) снимали на приборе СФ-46 в интервале длин волн Х.=400—1100 нм. Фитосистемы характеризовали мутностью (т) в диапазоне ^=800-1000 нм, в котором поглощение (К) практически отсутствует (D-C=K+x; К=*0 и Саги). Значение тХср рассчитывали при Хср=900 нм. Параметры дисперсных частиц (средний
размер (Г), массовую (М) и числовую (N) концентрации) определяли методом спектра мутности [7].
Настои крапивы характеризовали массой сырья в 100 мл дистиллированной воды (С, г/100 мл) и содержанием сухих веществ (Ссв, г/дл).
В табл. 1 приведена физико-химическая характеристика настоев листьев и корней крапивы.
Таблица 1
Сравнительная характеристика настоев листьев и корней крапивы
| № | РН | С, | Сс в, | Тхср, см 1 | Г х, нм | М Ю3, | N-10"7, |
| фитонастоя | г/100мл | г/дл | г/дл | см"3 | |||
| 1. Листья | 6.8 | 0.5 | 0.15 | не фик- | - | - | - |
| крапивы + | сирует- | ||||||
| вода | ся | ||||||
| 2. Листья | 6.8 | 2.5 | 0.56 | 0.64 | 260 | 0.013 | 340.0 |
| крапивы + | |||||||
| вода | |||||||
| 3. Корни | 6.9 | 5.0 | 0.20 | 0.22 | 400 | 4.50 | 14.8 |
| крапивы + | |||||||
| вода | |||||||
| 4. Листья | 4.8 | 0.5 | 0.15 | не фик- | - | - | - |
| крапивы + | сирует- | ||||||
| ацетатный | ся | ||||||
| буфер | |||||||
| 5. Корни | 4.4 | 5.0 | 0.20 | 0.89 | 1400 | 6.70 | 0.5 |
| крапивы + | |||||||
| ацетатный | |||||||
| буфер |
Из табл. 1 следует, что фитонастои (1 и 3-5) разных частей крапивы с близким содержанием сухих веществ можно получить при использовании сухих листьев и сырых корней в соотношении С=1:10. При этом настои листьев (1,4)- молекулярные растворы, настои корней (3, 5) - коллоидные растворы. В кислой среде степень дисперсности коллоидного раствора 5 возрастает: увеличивается мутность, размер и массовая концентрация частиц. Этот процесс, по-видимому, обусловлен образованием, объединением и последующим осаждением частиц. Появление мелких частиц происходит и в фитонастое 2 при увеличении (~ в 4 раза) содержания сухих веществ.
Большой интерес представляет сопоставление гидродинамических свойств раствора и фитосистем ХТЗ, а также их изменение от температуры и времени хранения. В табл. 2 приведены значения предельного числа вязкости ([л]) фитосистем полимера при разных температурах.
Таблица 2
Характеристика фитосистем хитозана
| Система | Сев. настоя, г/дл | РН | [Л]25°с, ДЛ/Г | [лГ^.Дп/г |
| 1. ХТЗ + ацетатный | 4.8 | 11.9 | 9.4 | |
| буфер | ||||
| 2. ХТЗ + ацетатный | 0.15 | 4.8 | 3.6 | - |
| буфер + настой | ||||
| листьев крапивы | ||||
| 3. ХТЗ + ацетатный | 0.20 | 4.4 | 4.1 | 2.7 |
| буфер + настой | ||||
| корней крапивы |
Как видно из табл. 2, с повышением температуры [nj раствора ХТЗ (1) уменьшается. Такое поведение [л] от температуры является типичным для природных полисахаридов (классический пример - производные целлюлозы) и свидетельствует об отрицательном температурном коэффициенте вязкости [8]. Из этого следует, что размеры макромолекул ХТЗ в значительной степени определяются равновесной жесткостью цепи (близкодействие).
Введение настоев листьев и корней крапивы в раствор ХТЗ приводит к практически одинаковому снижению [л]. Эффект падения [л] фитосистемы 3 не изменяется и с повышением температуры до
40° с, [л]отн25"Чп]отн40"с[б].
По нашему мнению такое падение [л] связано с процессом ком-плексообразования, которое продолжается при хранении фитосистем (рис. 1).
Интенсивное падение [л] наблюдается в первые 7 суток. При дальнейшем хранении фитосистем до -20 суток [л] не изменяется. Зафиксировано, что хранение их при температуре ~ 6° С замедляет падение вязкости (кр. 3). Обнаружено также, что [л] фитосистемы, хранившейся при - 6°С в течение 23 суток, измеренная при 40° С ([л]40"с=2.2 дл/г) по величине близка к [л] фитосистемы, тоже хранившейся 23 суток, но при Тз20° С ([л]25°с=2.0 дл/г).
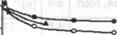
Рис. 1. Зависимость от времени предельного числа вязкости раствора ХТЗ (1) и фитосистем ХТЗ: с настоями листьев (2) и корней (4) крапивы при температуре хранения - 20° С; с настоем корней крапивы при - 6° С (3).
Образование комплексов следует и из анализа рис. 2. Видно, что фитосистема ХТЗ с настоем корней крапивы является дисперсной системой. Степень дисперсности ее повышается при хранении до 20 сут. и не зависит от температуры хранения (кривые 3, 4). Параметры дисперсных частиц фитосистемы 3 (из табл. 2) приведены в табл. 3.

Рис. 2. Спектры поглощения свежеприготовленных фитосистем ХТЗ с настоями листьев (1) и корней крапивы (2); фитосистем ХТЗ с настоем корней крапивы через 20 суток хранения при температуре ~ 20 °С (4) и - 6 °С (3).
Таблица 3
Изменение параметров дисперсных частиц фитосистемы
| Параметры частиц | В | эемя хранения, сут. | |
| 0 | 21 | ||
| температура хранения | |||
| 20" С | 20° С | 6° С | |
| РН Тхср. см Г х, нм М-103, г/дл N-10~7, см"3 |
4.5 0.27 270 8.1 79.1 |
4.5 0.54 1050 4.1 0.71 |
4.5 0.48 1200 3.6 0.41 |
Согласно табл. 3 во времени происходит увеличение мутности системы и размера дисперсных частиц, что, в свою очередь, приводит к их оседанию (М и N - уменьшаются).
Таким образом, на основании полученных результатов можно констатировать, что компоненты настоев крапивы взаимодействуют с макромолекулами хитозана с образованием растворимых и нерастворимых (дисперсных частиц) комплексов.
ЛИТЕРАТУРА
- Трескунов К.А., Трескунова O.K., Комаров Б.А., Горошетченко А.В. // Матер, науч. конф. «Фитотерапия, лазеротерапия, биологически активные вещества естественного происхождения (БАВЕП) в XXI веке». Черноголовка, 2000. С. 158.
- Новые достижения в исследовании хитина и хитозана. Сборник статей VI международной конференции. М.: Изд-во ВНИРО, 2001.
- Трескунов К.А., Комаров Б.А., Горошетченко А.В., Широкова O.K., Игнатьев Ю.Г. // Матер. VII международной конф. «Современные перспективы в исследовании хитина и хитозана». Санкт-Петербург - Репино, 2003. С. 198-203.
- Комаров Б.А., Албулов А.И., Погорельская Л.В., Трескунов К.А. // Матер. VII международной конф. «Современные перспективы в исследовании хитина и хитозана». Санкт-Петербург - Репино, 2003. С. 246-250.
- Фомина В.И., Солонина Н.А., Кленин В.И., Комаров Б.А., Тимофеева Г.Н., Шиповская А.Б. // Структура и динамика молекулярных систем: сборник статей. Уфа: Изд-во института физики молекул и кристаллов УНЦ РАН, 2002. Вып. IX. Т. 2. С. 205-208.
- Фомина В.И., Солонина Н.А., Комаров Б.А., Тимофеева Г.Н., Шиповская А.Б. // Нетрадиционные природные ресурсы, инновационные технологии и продукты: сборник статей. М.: Изд-во РАЕН-МААНОИ, 2003. Вып. 9. С. 165-170.
- Кленин В.И. Термодинамика систем с гибкоцепными полимерами. Саратов: Изд-во Сарат. ун-та. 1995.
- Цветков В.Н. Жесткоцепные полимерные молекулы. П.: Наука. 1986. С. 380.